Перейти к:
Острый инфаркт миокарда у пациентов с сопутствующим гипотиреозом: особенности клиники и вариабельности ритма сердца в период стационарного лечения
https://doi.org/10.21886/2712-8156-2024-5-2-48-57
Аннотация
Цель: оценить особенности клинического течения, а также вариабельности ритма сердца (ВРС) в период стационарного лечения у пациентов с инфарктом миокарда с подъёмом сегмента ST (ИМпST) и сопутствующим впервые выявленным гипотиреозом.
Материалы и методы: в исследование включили 133 пациента с ИМпST в возрасте от 40 до 88 лет, поступивших в кардиологическое отделение. В зависимости от наличия впервые выявленного синдрома гипотиреоза всех больных распределили в 3 группы: 1-ю группу составили пациенты с ИМпST без синдрома гипотиреоза (n=57), 2А группу — пациенты с ИМпST и субклиническим гипотиреозом (n=42) и 2Б группу — пациенты с ИМпST и манифестным гипотиреозом (n=34). У всех пациентов проводили оценку клинических симптомов и осложнений в остром периоде ИМ, выполняли холтеровское мониторирование ЭКГ (ХМ ЭКГ).
Результаты: в период госпитального лечения у пациентов с сопутствующим манифестным гипотиреозом отмечалось более частое развитие нарушений ритма сердца по типу пароксизмальной фибрилляции предсердий (ФП) (p<0,05), наджелудочковой экстрасистолии (НЖЭ), пароксизмальной наджелудочковой тахикардии (НЖТ) (p<0,05). При оценке риска развития ранних осложнений в острый период ИМ более высокие баллы регистрировались у пациентов с манифестным гипотиреозом (p<0,05). Анализ показателей ВРС показал, что у исследуемых больных с сопутствующим манифестным гипотиреозом, несмотря на наличие острого периода ИМ, превалирует активация парасимпатического звена ВНС (вегетативной нервной системы) в регуляции сердечного ритма в отличие от пациентов группы контроля и группы с субклиническим гипотиреозом, у которых, напротив, преобладает влияние симпатического звена ВНС.
Заключение: в период госпитализации у пациентов с манифестным гипотиреозом статистически значимо чаще развивались наджелудочковые нарушения ритма сердца, определялся более высокий риск сердечно-сосудистых осложнений в остром периоде ИМ по сравнению как с группой контроля, так и группой пациентов с субклиническим гипотиреозом. У больных с сопутствующим манифестным гипотиреозом более выражена активация парасимпатического звена ВНС в регуляции сердечного ритма в отличие от пациентов группы контроля и группы с субклиническим гипотиреозом, у которых, напротив, преобладает влияние симпатического звена ВНС.
Ключевые слова
Для цитирования:
Гриднева Ю.Ю., Чесникова А.И., Сафроненко В.А., Воронова А.В. Острый инфаркт миокарда у пациентов с сопутствующим гипотиреозом: особенности клиники и вариабельности ритма сердца в период стационарного лечения. Южно-Российский журнал терапевтической практики. 2024;5(2):48-57. https://doi.org/10.21886/2712-8156-2024-5-2-48-57
For citation:
Gridneva Yu.Yu., Chesnikova A.I., Safronenko V.A., Voronova A.V. Acute myocardial infarction in patients with concomitant hypothyroidism: clinical features and heart rate variability during inpatient treatment. South Russian Journal of Therapeutic Practice. 2024;5(2):48-57. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-2-48-57
Введение
Современные исследования и данные эпидемиологических наблюдений показали, что дисфункция щитовидной железы ассоциирована с более высокой частотой осложнений и смертности от сердечно-сосудистых заболеваний (ССЗ) [1–7]. По сравнению с эутиреоидными лицами у пациентов с гипотиреозом чаще развиваются гипертония, дислипидемия, эндотелиальная дисфункция и фиброз миокарда, а также они более склонны к событиям ишемической болезни сердца (ИБС) и смерти от ИБС [8–15]. Согласно данным литературы, гипотиреоз нередко встречается среди пациентов с инфарктом миокарда с подъёмом сегмента ST (ИМпST), в том числе получавших чрескожное коронарное вмешательство (ЧКВ), и может служить прогностическим маркером неблагоприятных внутрибольничных событий и повышенной краткосрочной и долгосрочной смертности [6][7]. Именно поэтому интерес исследователей к изучению функции щитовидной железы у пациентов с ИБС, в том числе инфаркт миокарда (ИМ), в последнее время возрастает [16][17].
В настоящее время чётко установлена тесная связь состояния сердечно-сосудистой системы с заболеваниями щитовидной железы. При этом даже небольшие нарушения функции щитовидной железы могут вызвать изменения частоты и ритма сердечных сокращений миокарда [8]. Чаще поражения щитовидной железы имеет характер неявного клинически выраженного заболевания, а протекает скрыто, субклинически, что затрудняет его раннюю диагностику [8][9].
Гипотиреоз оказывает влияние на вегетативную нервную систему (ВНС), стимуляция которой приводит к увеличению силы и частоты сердечных сокращений, скорости проведения импульса по проводящей системе сердца и миокарда и вызывает вазодилатацию коронарных сосудов. Результатом интегративных воздействий регуляторных систем организма на сердечный ритм является вариабельность сердечного ритма (ВСР) [18–20].
Известно, что аритмии сердца ассоциируются с высоким риском внезапной смерти, чувствительной к регуляторным влияниям, прежде всего к симпатической активности. Этим объясняется исключительно высокая прогностическая ценность анализа ВСР при риске внезапной смерти [18–20].
Многие исследователи оценивали параметры ВСР при гипотиреозе, в том числе на фоне заместительной терапии, но результаты остаются противоречивыми, хотя все они имеют тенденцию к изменению парасимпатической и симпатической активности при гипотиреозе по сравнению со здоровыми людьми [20]. Лишь в немногих исследованиях проводилась всесторонняя оценка влияния гипофункции щитовидной железы на параметры ВСР при ИБС [20], однако баланс ВНС у пациентов в остром периоде ИМ при наличии сопутствующего гипотиреоза в настоящее время остаётся недостаточно изученным.
Цель исследования — оценить особенности клинического течения, а также вариабельности ритма сердца в период стационарного лечения у пациентов с инфарктом миокарда с подъёмом сегмента ST (ИМпST) и сопутствующим впервые выявленным гипотиреозом.
Материалы и методы
В исследование включили 133 пациента с ИМпST в возрасте от 40 до 88 лет, поступивших в кардиологическое отделение с ИМпST в период с января по декабрь 2022 г. Исследование выполнялось в условиях кардиологического отделения Ростовской областной клинической больницы г. Ростова-на-Дону. Работа соответствовала стандартам Хельсинской декларации, была одобрена независимым этическим комитетом ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России (протокол № 16/21 от 21.10.2021 г.). Все лица, включённые в исследование, подписали письменное информированное добровольное согласие на участие в нём.
Критерии включения в исследование — пациенты с острым ИМпST без дисфункции щитовидной железы и с впервые выявленными субклиническим или манифестным гипотиреозом, подписавшие добровольное согласие на участие в исследовании.
Критериями исключения из исследования — приём амиодарона на момент поступления и в анамнезе, коронавирусная инфекция COVID-19 (положительный ПЦР-мазок) при госпитализации и в период стационарного лечения, оперативные вмешательства на щитовидной железе, гемодинамически значимые пороки сердца; онкологические заболевания, явления сосудистого делирия, тяжёлая патология печени и почек, острое нарушение мозгового кровообращения (ОНМК) и транзиторная ишемическая атака (ТИА) в течение последних 6 месяцев, психические заболевания, не позволяющие подписать добровольное согласие и участвовать в исследовании.
В зависимости от наличия впервые выявленного синдрома гипотиреоза всех больных с ИМпST распределили в три группы: 1-ю группу (группу контроля, n=57) составили пациенты с ИМпST без синдрома гипотиреоза (средний возраст — 60,09 ± 1,2 лет). С учётом выраженности гипотиреоза пациентов с впервые выявленным гипотиреозом разделили на две группы: в 2А группу (n=42) вошли пациенты с ИМпST и субклиническим гипотиреозом (средний возраст — 60,95 ± 1,73 лет), в 2Б группу (n=34) — пациенты с ИМпST и манифестным гипотиреозом (средний возраст — 64,59 ± 1,6 лет).
Диагноз ИМпST устанавливали при наличии положительного высокочувствительного тропонинового теста (более 40 нг/л) и по данным электрокардиограммы (элевация сегмента ST более 2 мм). Локализация инфарцирования преимущественно по передней или нижней стенке левого желудочка практически сопоставима, статистически значимых отличий между группами выявлено не было (p>0,05). Всем пациентам было выполнено ЧКВ и стентирование инфаркт-зависимой артерии стентами с лекарственным покрытием, лечение ИМпST проводили согласно современным клиническим рекомендациям [6][7].
Для оценки функции щитовидной железы определяли концентрацию тиреотропного гормона (ТТГ), уровни свободного трийодтиронина (св. Т3) и свободного тироксина (св. Т4), антитела к тиреоидной пероксидазе (Ат-ТПО), проводили ультразвуковое исследование щитовидной железы.
О «субклиническом гипотиреозе» судили в случаях, когда у пациентов определяли повышение уровня ТТГ более 4,0 мкМЕ/мл без характерных кинических симптомов и при показателях свободных Т3 и Т4 в пределах нормы. Манифестный гипотиреоз выявляли при повышении уровня ТТГ более 4,0 мкМЕ/мл и снижении уровня тиреоидных гормонов (св. Т4) ниже референсных значений, а также с учётом характерных клинических симптомов.
Лечение пациентов с манифестным гипотиреозом проводили согласно современным клиническим рекомендациям [10].
Данные о клинических симптомах и осложнениях у каждого пациента отражали в специально разработанных анкетах.
С целью оценки частоты нарушений ритма и проводимости, а также параметров ВРС всем пациентам проводили холтеровское мониторирование ЭКГ (ХМ ЭКГ). В исследовании анализу подвергались общепринятые по методическому стандарту показатели: максимальная, минимальная и средняя ЧСС в сутки, значения циркадного индекса (ЦИ) и ВРС, частота встречаемости различных НРС и проводимости.
Статистическая обработка полученных результатов выполнялась при помощи прикладной программы Statistica 12.0 (производитель — StatSoft Inc., CША). Проверка выборки на соответствие нормальному распределению осуществлялась с применением критерия Шапиро-Уилка. Количественные данные, соответствующие нормальному распределению, приведены в виде среднего и стандартного отклонения (M ± m). Количественные данные, отличающиеся от нормального распределения, описаны медианой и интерквартильным размахом (Me [Q1–Q3]). Качественные переменные представлены в виде абсолютных (n) и относительных (%) величин. Сравнение групп по качественным признакам проводилось посредством критерия Хи-квадрат с поправкой Йетса, по количественным признакам — с помощью критерия Манна-Уитни для двух независимых групп. Для сравнения трёх групп пациентов использовался критерий ANOVA Краскела-Уоллиса. За критический уровень достоверности нулевой статистической гипотезы принимали рmg <0,05.
Результаты
Сравнительный анализ частоты встречаемости аритмий при поступлении в стационар показал, что статистически значимо чаще нарушения ритма по типу НЖЭ и пароксизмальной НЖТ выявлялись у пациентов с манифестным гипотиреозом (2Б группа) по сравнению как с контрольной группой (p<0,001), так и пациентами с субклиническим гипотиреозом (р<0,001). Согласно полученным данным, во 2Б группе чаще наблюдалась пароксизмальная ФП, чем в группе контроля (р=0,005), причём в 100% случаев синусовый ритм был восстановлен.
Анализ клинических проявлений в период госпитального этапа лечения пациентов с ИМпST исследуемых групп представлен в таблице 1.
Таблица 1
Клиническая характеристика пациентов с ИМпST
в период госпитального этапа лечения
Clinical characteristics of patients with ST-segment elevation myocardial infarction
during the hospital stage of treatment
Группы
Показатели | Контрольная группа (1 группа, n=57) | Субклинический гипотиреоз (2А группа, n=42) | Манифестный гипотиреоз (2Б группа, n=34) | р 1-2А | р 1-2Б | р 2А-2Б | Рmg |
Инфаркт как дебют (%) | 49,12 | 61,9 | 41,18 | 0,206 | 0,461 | 0,071 | 0,181 |
Нарушения ритма сердца по типу НЖЭ и НЖТ при поступлении (%) | 7,02 | 4,76 | 35,29 | 0,638 | <0,001 | <0,001 | <0,001 |
ФЖ (%) | 7,02 | 2,38 | 8,82 | 0,277 | 0,756 | 0,206 | 0,412 |
ФП при поступлении (%) | 8,77 | 16,67 | 32,35 | 0,237 | 0,005 | 0,110 | 0,019 |
ЧСС, (уд./мин.) | 67 [ 67;80] | 70 [ 67;86] | 75 [ 60;80] | 0,821 | 0,99 | 0,99 | 0,525 |
САД (мм рт. ст.) | 140 [ 130;140] | 140 [ 130;140] | 140 [ 120;140] | 0,99 | 0,99 | 0,99 | 0,931 |
ДАД (мм рт. ст.) | 90 [ 90;90] | 90 [ 80;90] | 90 [ 78;90] | 0,99 | 0,148 | 0,720 | 0,064 |
Отёк лёгких (%) | 1,75 | 9,52 | 8,82 | 0,078 | 0,117 | 0,916 | 0,157 |
Кардиогенный шок (%) | 5,26 | 9,52 | 11,76 | 0,417 | 0,269 | 0,752 | 0,511 |
ХСН при выписке (%) | 68,42 | 61,9 | 64,71 | 0,501 | 0,716 | 0,801 | 0,793 |
Примечание: p — достоверность различий, рmg — межгрупповое сравнение, p1-2А — сравнение 2А и 1-й групп, p1-2Б — сравнение 2Б и 1-й групп, p2А-2Б — сравнение 2А и 2Б групп, НЖЭ — наджелудочковая экстрасистолия, НЖТ — пароксизмальная наджелудочковая тахикардия, ХСН — хроническая сердечная недостаточность, ФЖ — фибрилляция желудочков, ФП — фибрилляция предсердий, ЧСС — частота сердечных сокращений, САД — систолическое артериальное давление, ДАД — диастолическое артериальное давление.
Note: p — reliability of differences, рmg — intergroup comparison, p1-2А — comparison of 2A and 1st groups, p1-2Б — comparison of 2B and 1st groups, p2А-2Б — comparison of groups 2A and 2B, SVE — supraventricular extrasystole, PSVT — paroxysmal supraventricular tachycardia, CHF — chronic heart failure, VF — ventricular fibrillation, AF — atrial fibrillation, HR — heart rate, SBP — systolic blood pressure, DBP — diastolic blood pressure.
Как известно, шкала TIMI обеспечивает оценку механических и электрофизиологических осложнений [19]. Риск смерти или ИМ в ближайшие две недели оценивается по сумме баллов от 0 до 6. Результаты оценки риска развития ранних осложнений ИМпST по шкале TIMI у больных исследуемых групп представлены на рисунке 1.
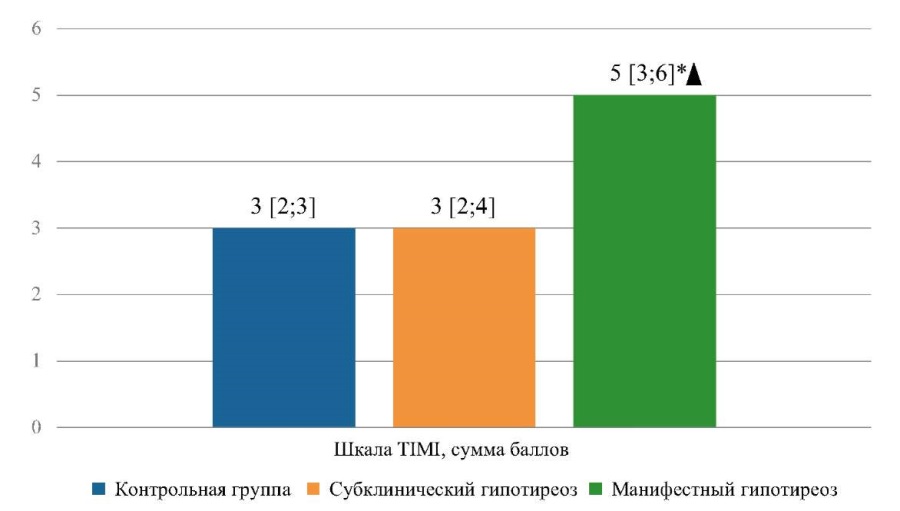
Рисунок 1. Результаты оценки риска развития ранних осложнений инфаркта миокарда у больных исследуемых групп
Примечание: * — p <0,001 — при сравнении группы пациентов с манифестным гипотиреозом с группами контроля, ▲ — р = 0,002 при сравнении с пациентами с субклиническим гипотиреозом.
Picture 1. Results of assessing the risk of developing early complications of myocardial infarction in patients in the study groups
Note: * — p <0,001 — when comparing a group of patients with overt hypothyroidism with control groups, ▲ — р = 0,002 when compared with patients with subclinical hypothyroidism.
По результатам оценки шкалы TIMI в исследуемых группах установлено, что средняя сумма баллов у пациентов с манифестным гипотиреозом составила 5 [ 3; 6], что статистически значимо больше, чем у пациентов групп контроля (3 [ 2; 3], р<0,001) и пациентов с субклиническим гипотиреозом (3 [ 2; 4], р=0,002). Необходимо обратить внимание, что за период госпитализации летальных случаев ни в одной группе пациентов не наблюдалось.
Важной задачей настоящего исследования явилось изучение частоты нарушений ритма (НРС), проводимости сердца и анализа вариабельности ритма сердца (ВРС) в острый период ИМпST по данным ХМ ЭКГ.
Сравнительный анализ средней ЧСС за сутки выявил более низкие значения у пациентов с манифестным гипотиреозом (2Б группа) по сравнению с контрольной группой (61 [ 59; 65] и 69 [ 62; 75] соответственно, р=0,004), при этом различий данного показателя ЧСС при сравнении группы пациентов субклинического гипотиреоза (2А группа) с группами контроля и манифестного гипотиреоза не выявлено (p>0,05). Максимальная ЧСС днём и ночью у пациентов исследуемых групп не отличалась.
Результаты сравнительного анализа НРС и проводимости по данным ХМ ЭКГ у больных исследуемых групп позволили установить, что более частая встречаемость пароксизмов ФП наблюдалась в группе пациентов с манифестным гипотиреозом по сравнению с контрольной группой (р=0,023) и группой с субклиническим гипотиреозом (р=0,036). Эпизоды AV-блокад чаще встречались в группе с манифестным гипотиреозом по сравнению с контрольной группой (р=0,045). Важно подчеркнуть, что статистически значимых различий при сравнении нарушений ритма и проводимости у пациентов групп контроля и субклинического гипотиреоза не выявлено (p>0,05).
Анализ показателей ВРС у больных исследуемых групп представлен в таблице 2.
Таблица 2
Анализ показателей вариабельности ритма сердца у больных исследуемых групп
Analysis of heart rate variability indicators in patients in the study groups
Группы Показатели | Контрольная группа (1 группа, n=57) | Субклинический гипотиреоз (2А группа, n=42) | Манифестный гипотиреоз (2Б группа, n=34) | р 1-2А | р 1-2Б | р 2А-2Б | Рmg |
Mean | 864 [ 804;964] | 918 [ 828;1012] | 980 [ 920;1004] | 0,667 | 0,005 | 0,184 | 0,007 |
SDNN | 95 [ 76;113] | 96 [ 72;118] | 109 [ 88;151] | 0,981 | 0,026 | 0,075 | 0,022 |
SDNNi | 44 [ 31;55] | 39 [ 33;49] | 54 [ 32;67] | 0,990 | 0,568 | 0,161 | 0,151 |
SDANN | 83 [ 62;99] | 82 [ 60;103] | 99 [ 74;134] | 0,957 | 0,071 | 0,194 | 0,063 |
rMSSD | 28 [ 21;43] | 24,5 [ 20;35] | 46 [ 22;70] | 0,954 | 0,062 | 0,008 | 0,009 |
PNN50 | 3 [ 1;7] | 2 [ 1;7] | 8 [ 2;15] | 0,977 | 0,008 | 0,003 | 0,002 |
ЦИ | 1,1 [ 1,05;1,14] | 1,09 [ 1,02;1,14] | 1,13 [ 1,03;1,19] | 0,985 | 0,456 | 0,293 | 0,215 |
ЦИ <1,24, (%) | 98,25% | 92,86% | 79,41% | 0,177 | 0,002 | 0,083 | 0,007 |
Примечание: p — достоверность различий, рmg — межгрупповое сравнение, p1-2 — сравнение 2-й и 1-й групп, p1-2А — сравнение 2А и 1-й групп, p1-2Б — сравнение 2Б и 1-й групп, p2А-2Б — сравнение 2А и 2Б групп.
Note: p — reliability of differences, рmg — intergroup comparison, p1-2А — comparison of 2A and 1st groups, p1-2Б — comparison of 2B and 1st groups, p2А-2Б — comparison of groups 2A and 2B.
При оценке временных показателей ВРС установлено, что параметр pNN50 выше в группе пациентов с манифестным гипотиреозом по сравнению с контрольной группой (р=0,008) и группой с субклиническим гипотиреозом (р=0,003), а показатель rMSSD выше при сравнении с субклиническим гипотиреозом (р=0,008). Показатели Mean и SDNN в группе с манифестным гипотиреозом (2Б группа) также был выше по сравнению с показателями контрольной группы (р=0,005 и р=0,026 соответственно). Данный факт позволил интерпретировать полученные результаты как активацию влияния парасимпатического звена ВНС и ослабление симпатического звена в регуляции сердечного ритма у пациентов с манифестным гипотиреозом, несмотря на острый период ИМ. Важно отметить, что в контрольной группе и в группе пациентов с субклиническим гипотиреозом преобладают влияния симпатического отдела нервной системы.
Обращает на себя внимание тот факт, что снижение ЦИ<1,24 значимо чаще регистрировались у больных контрольной группы по сравнению с группой пациентов с манифестным гипотиреозом (р=0,002), что позволяет судить об активности симпатической нервной системы и риске развития неблагоприятных сердечно-сосудистых событий. В группе пациентов с манифестным гипотиреозом меньший процент пациентов с показателем ЦИ<1,24, по-видимому, обусловлен чрезмерной активностью парасимпатической нервной системы, что также определяет высокий риск сердечно-сосудистых событий. Необходимо отметить, что процент случаев показателя ЦИ<1,24 у пациентов в группе субклинического гипотиреоза и группе контроля значимо не отличался [21–23].
Обсуждение
Согласно результатам настоящего исследования, не установлены статистически значимые отличия по таким показателям, как частота развития ИМ как дебюта заболевания, сердечной недостаточности и кардиогенного шока у пациентов сравниваемых групп за период наблюдения в стационаре. Однако, по данным литературы, даже субклинический гипотиреоз может приводить к наиболее выраженным клиническим проявлениям в остром периоде ИМ [18]. Возможно, продолжение исследования с включением большего числа пациентов в группы позволит получить дополнительную информацию.
Известно, что снижение уровня циркулирующих гормонов щитовидной железы может изменять сердечную возбудимость и проводимость, приводя к блокаде сердца и брадиаритмиям, а также к наджелудочковым и желудочковым тахиаритмиям [5].
При анализе частоты развития нарушений ритма сердца при поступлении в стационар показано, что значимо чаще регистрировались наджелудочковые нарушения ритма сердца по типу НЖЭ и пароксизмальной НЖТ у пациентов с манифестным гипотиреозом по сравнению с контрольной группой и пациентами с субклиническим гипотиреозом (р<0,001), а также значимо чаще выявлялась ФП у пациентов в группе манифестного гипотиреоза в остром периоде ИМ, чем в контрольной (р=0,005), что подтверждает данные литературы [18]. При анализе возможных причин более частого возникновения наджелудочковых нарушений ритма сердца у пациентов с манифестным гипотиреозом следует отметить, что, как известно, риск развития аритмий повышается с возрастом при наличии АГ, ИБС, которые чаще встречались у пациентов с манифестным гипотиреозом [18]. Согласно литературным данным, наличие ФП взаимосвязано с системным воспалением, при котором повышается уровень С-реактивного белка. Можно предположить, что причины более частого возникновения ФП у пациентов с гипотиреозом является наличие системного воспаления [18].
В ряде исследований показано, что манифестный гипотиреоз ассоциирован с более высокой частотой осложнений и смертностью от ССЗ [11][12]. Результаты настоящего исследования не противоречат данным литературы, так как анализ показателей по шкале TIMI у пациентов с манифестным гипотиреозом выявлен более высокий риск сердечно-сосудистых осложнений на госпитальном этапе лечения ИМпST по сравнению с пациентами контрольной группы (p <0,001) и пациентами группы с субклиническим гипотиреозом (p=0,002). Согласно результатам настоящего исследования, наличие сопутствующего субклинического гипотиреоза не повышало риск сердечно-сосудистых осложнений в остром периоде ИМ. Однако, согласно данным ряда исследователей, даже колебания уровней ТТГ в пределах нормальных величин могут быть связаны с риском неблагоприятных сердечно-сосудистых событий [18].
Известно, что у пациентов с субклиническим и манифестным гипотиреозом наблюдаются более длительная продолжительность зубца P, более длинный интервал PR и низкий вольтаж [24], что не противоречит полученным данным о минимальной ЧСС в дневное и ночное время, которая также ниже у пациентов с сопутствующим манифестным гипотиреозом по сравнению с контрольной группой и с субклиническим гипотиреозом (р<0,05).
Согласно данным литературы, гипотиреоз способствует более высокому риску развития не только ИБС, но и нарушений ритма и проводимости сердца, таких как желудочковые аритмии и атриовентрикулярные блокады сердца [4]. Однако результаты сравнительного анализа НРС по данным ХМ ЭКГ у больных исследуемых групп не выявили значимых различий в частоте развития желудочковых тахикардий, а также частой желудочковой экстрасистолии и синусовой аритмии (p>0,05).
По мнению одних авторов, гипотиреоз не способствует повышению риска ФП, но существует значительное совпадение между этими состояниями из-за общих факторов риска [25]. Однако другие авторы утверждают, что укорочение предсердного эффективного рефрактерного периода за счёт изменения уровня белка ионных каналов и структурных изменений предсердий повышало предрасположенность к ФП при гипотиреозе [26][27]. В ходе настоящего исследования установлена более частая встречаемость пароксизмов ФП в группе пациентов с манифестным гипотиреозом по сравнению с контрольной группой (р=0,023) и группой с субклиническим гипотиреозом (р=0,036), что соответствует данным литературы [18].
Эпизоды AV-блокад чаще встречались в группе пациентов с манифестным гипотиреозом по сравнению с контрольной группой (р=0,045), что соответствует данным других авторов [4][5].
Как известно, ВСР является маркером при стратификации риска смертности от всех причин у пациентов с ИМпST, что обусловлено чрезмерной активацией симпатической нервной системы [23][24][28]. По данным метаанализов с участием пациентов с известными ССЗ установлено, что у пациентов с более низкой ВСР наблюдается более высокий риск повторных инфарктов и сердечно-сосудистой смерти [23][29]. В исследованиях показано, что пациенты с ИМпST с самыми низкими значениями SDNN, свидетельствующими о выраженной активации симпатической нервной системы, имели повышенный риск смерти от всех причин и смертности от сердечно-сосудистых заболеваний. Однако, как известно, клинические признаки гипотиреоза предполагают гипоактивность симпатической и активацию парасимпатической нервной системы, которая характеризуется снижением частоты сердечных сокращений, снижением сердечного выброса и сократимости сердца, а также возникновением желудочковых нарушений ритма [22]. В литературе нет однозначного мнения о преобладании активности симпатической или парасимпатической звеньев ВНС при данной сочетанной патологии.
В настоящем исследовании анализ временных показателей ВРС позволил установить активацию влияния парасимпатического звена ВНС и ослабление симпатического звена в регуляции сердечного ритма у пациентов с манифестным гипотиреозом, несмотря на острый период ИМ, что, вероятно, связано с утратой стимуляционных влияний тиреоидных гормонов на симпатический отдел вегетативной нервной системы при одновременном усилении парасимпатических влияний на сердечно-сосудистую систему. Как известно, повышенная активность парасимпатической нервной системы также ассоциирована с повышением сердечно-сосудистой смертности [22][23].
Важно отметить, что в группе пациентов с субклиническим гипотиреозом регистрировалась более высокая активность симпатического отдела нервной системы, характерная для острого периода ИМ.
Согласно результатам ряда исследований, у пациентов с ИМ и жизнеугрожающими нарушениями ритма сердца показатели ЦИ ниже, чем у здоровых людей [22]. Необходимо подчеркнуть, что не столь выраженные изменения ЦИ в исследуемых группах обусловлены, вероятно, применением бета-блокаторов в лечении острого ИМпST, согласно современным клиническим рекомендациям [7]. Снижение ЦИ<1,24, позволяющее судить об активности симпатической нервной системы и риске развития неблагоприятных сердечно-сосудистых событий, значимо чаще регистрировалось у больных контрольной группы (р=0,002). В группе пациентов с манифестным гипотиреозом меньший процент пациентов с показателем ЦИ<1,24, по-видимому, обусловлен чрезмерной активностью парасимпатической нервной системы, что также определяет высокий риск сердечно-сосудистых событий.
С учётом полученных данных анализа ВРС в группах установлено, что у пациентов контрольной группы и у пациентов с субклиническим гипотиреозом более выражена активность симпатического отдела ВНС в регуляции сердечного ритма в отличие от пациентов с сопутствующим манифестным гипотиреозом, у которых усилены парасимпатические влияния, несмотря на острый период ИМ.
Полученные данные позволяют судить о необходимости оценки ВРС у пациентов с ИМпST и сопутствующим гипотиреозом с целью дифференцированного подхода к выбору лекарственной терапии.
Заключение
У пациентов с манифестным гипотиреозом в период госпитализации статистически значимо чаще развивались наджелудочковые нарушения ритма сердца, в том числе ФП, определялся более высокий риск сердечно-сосудистых осложнений в остром периоде ИМ по сравнению с группой контроля и группой пациентов с субклиническим гипотиреозом. Кроме того, у пациентов с манифестным гипотиреозом чаще встречались эпизоды AV-блокад по сравнению с контрольной группой.
При анализе параметров ВРС установлено, что у больных с сопутствующим манифестным гипотиреозом, несмотря на острый период ИМ, превалирует активация парасимпатического звена ВНС в регуляции сердечного ритма, а у пациентов с субклиническим гипотиреозом более выражена симпатическая регуляция ВНС, как и в группе пациентов без дисфункции щитовидной железы, что важно учитывать при выборе тактики ведения больных.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
1. Izkhakov E, Zahler D, Rozenfeld KL, Ravid D, Banai S, Topilsky Y, et al. Unknown Subclinical Hypothyroidism and In-Hospital Outcomes and Short- and Long-Term All-Cause Mortality among ST Segment Elevation Myocardial Infarction Patients Undergoing Percutaneous Coronary Intervention. J Clin Med. 2020;9(12):3829. DOI: 10.3390/jcm9123829
2. Nowbar AN, Gitto M, Howard JP, Francis DP, Al-Lamee R. Mortality From Ischemic Heart Disease. Circ Cardiovasc Qual Outcomes. 2019;12(6):e005375. DOI: 10.1161/CIRCOUTCOMES.118.005375
3. Корзухин А.Ю., Юлдошев Д.Р., Трошина А.А., Хурамшина Л.Р., Гузарик В.Н., Дырнаева А.Д., и др. Инфаркт миокарда 2-го типа: диагностические и терапевтические трудности в современной кардиологии. Комплексные проблемы сердечно-сосудистых заболеваний. 2023;12(3):84-97. DOI: 10.17802/2306-1278-2023-12-3-84-97
4. Huang R, Yan L, Lei Y, Li Y. Hypothyroidism and Complicated Sick Sinus Syndrome and Acute Severe Psychiatric Disorder: A Case Report. Int Med Case Rep J. 2021;14:171-176. DOI: 10.2147/IMCRJ.S296071
5. Fernandez-Ruocco J, Gallego M, Rodriguez-de-Yurre A, Zayas-Arrabal J, Echeazarra L, Alquiza A, et al. High Thyrotropin Is Critical for Cardiac Electrical Remodeling and Arrhythmia Vulnerability in Hypothyroidism. Thyroid. 2019;29(7):934-945. DOI: 10.1089/thy.2018.0709
6. Коробка В.Л., Хрипун А.В., Малеванный М.В., Куликовских Я.В. Ближайшие и среднеотдалённые результаты чрескожного коронарного вмешательства с имплантацией биорезорбируемых стентирующих каркасов при остром инфаркте миокарда с подъёмом сегмента ST. Эндоваскулярная хирургия. 2015;2(1–2):58-68. eLIBRARY ID: 27640351 EDN: XGWEYF
7. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российское кардиологическое общество, Ассоциация сердечно-сосудистых хирургов России. Российский кардиологический журнал. 2020;25(11):4103. DOI: 10.15829/1560-4071-2020-4103
8. Zghebi SS, Rutter MK, Sun LY, Ullah W, Rashid M, Ashcroft DM, et al. Comorbidity clusters and in-hospital outcomes in patients admitted with acute myocardial infarction in the USA: A national population-based study. PLoS One. 2023;18(10):e0293314. DOI: 10.1371/journal.pone.0293314
9. Canaris GJ, Manowitz NR, Mayor G, Ridgway EC. The Colorado thyroid disease prevalence study. Arch Intern Med. 2000;160(4):526-534. DOI: 10.1001/archinte.160.4.526
10. Национальное руководство. Эндокринология. — 2-е изд., перераб. и доп. Под ред. Дедова И.И., Мельниченко Г.А. ГЭОТАР-Медиа; 2022.
11. Collet TH, Gussekloo J, Bauer DC, den Elzen WP, Cappola AR, Balmer P, et al. Subclinical hyperthyroidism and the risk of coronary heart disease and mortality. Arch Intern Med. 2012;172(10):799-809. DOI: 10.1001/archinternmed.2012.402
12. Gencer B, Collet TH, Virgini V, Bauer DC, Gussekloo J, Cappola AR, et al. Subclinical thyroid dysfunction and the risk of heart failure events: an individual participant data analysis from 6 prospective cohorts. Circulation. 2012;126(9):1040-1049. DOI: 10.1161/CIRCULATIONAHA.112.096024
13. Чазова И.Е., Жернакова Ю.В. от имени экспертов. Клинические рекомендации. Диагностика и лечение артериальной гипертонии. Системные гипертензии. 2019;16(1):6–31. DOI: 10.26442/2075082X.2019.1.190179
14. Blum MR, Gencer B, Adam L, Feller M, Collet TH, da Costa BR, et al. Impact of Thyroid Hormone Therapy on Atherosclerosis in the Elderly With Subclinical Hypothyroidism: A Randomized Trial. J Clin Endocrinol Metab. 2018;103(8):2988-2997. DOI: 10.1210/jc.2018-00279
15. Gong N, Gao C, Chen X, Fang Y, Tian L. Endothelial Function in Patients with Subclinical Hypothyroidism: A Meta-Analysis. Horm Metab Res. 2019;51(11):691-702. DOI: 10.1055/a-1018-9564
16. Bano A, Chaker L, Muka T, Mattace-Raso FUS, Bally L, Franco OH, et al. Thyroid Function and the Risk of Fibrosis of the Liver, Heart, and Lung in Humans: A Systematic Review and Meta-Analysis. Thyroid. 2020;30(6):806-820. DOI: 10.1089/thy.2019.0572
17. Cheng X, Zhang H, Guan S, Zhao Q, Shan Y. Receptor modulators associated with the hypothalamus -pituitary-thyroid axis. Front Pharmacol. 2023;14:1291856. DOI: 10.3389/fphar.2023.1291856
18. Драпкина О.М., Гегенава Б.Б., Моргунова Т.Б., Фадеев В.В. Влияние гипотиреоза на сердечно-сосудистую систему. Эндокринология: Новости. Мнения. Обучение. 2016;2(15):21-30. eLIBRARY ID: 26484918 EDN: WHOUSX
19. Khan R, Zarak MS, Munir U, Ahmed K, Ullah A. Thrombolysis in Myocardial Infarction (TIMI) Risk Score Assessment for Complications in Acute Anterior Wall ST Elevation Myocardial Infarction. Cureus. 2020;12(6):e8646. DOI: 10.7759/cureus.8646
20. de Miranda ÉJFP, Hoshi RA, Bittencourt MS, Goulart AC, Santos IS, Brunoni AR, et al. Relationship between heart rate variability and subclinical thyroid disorders of the Brazilian Longitudinal Study of Adult Health (ELSA-Brasil). Braz J Med Biol Res. 2018;51(11):e7704. DOI: 10.1590/1414-431X20187704
21. Corona G, Croce L, Sparano C, Petrone L, Sforza A, Maggi M, et al. Thyroid and heart, a clinically relevant relationship. J Endocrinol Invest. 2021;44(12):2535-2544. DOI: 10.1007/s40618-021-01590-9
22. Brusseau V, Tauveron I, Bagheri R, Ugbolue UC, Magnon V, Navel V, et al. Heart rate variability in hypothyroid patients: A systematic review and meta-analysis. PLoS One. 2022;17(6):e0269277. DOI: 10.1371/journal.pone.0269277
23. Brinza C, Floria M, Covic A, Burlacu A. Measuring Heart Rate Variability in Patients Admitted with ST-Elevation Myocardial Infarction for the Prediction of Subsequent Cardiovascular Events: A Systematic Review. Medicina (Kaunas). 2021;57(10):1021. DOI: 10.3390/medicina57101021
24. Tayal B, Graff C, Selmer C, Kragholm KH, Kihlstrom M, Nielsen JB, et al. Thyroid dysfunction and electrocardiographic changes in subjects without arrhythmias: a cross-sectional study of primary healthcare subjects from Copenhagen. BMJ Open. 2019;9(6):e023854. DOI: 10.1136/bmjopen-2018-023854
25. Goldstein SA, Green J, Huber K, Wojdyla DM, Lopes RD, Alexander JH, et al. Characteristics and Outcomes of Atrial Fibrillation in Patients With Thyroid Disease (from the ARISTOTLE Trial). Am J Cardiol. 2019;124(9):1406-1412. DOI: 10.1016/j.amjcard.2019.07.046
26. Li J, Liu Z, Zhao H, Yun F, Liang Z, Wang D, et al. Alterations in atrial ion channels and tissue structure promote atrial fibrillation in hypothyroid rats. Endocrine. 2019;65(2):338-347. DOI: 10.1007/s12020-019-01968-z
27. Vasilopoulou A, Patsiou V, Bekiaridou A, Papazoglou AS, Moysidis DV, Spaho M, et al. Prognostic implications of thyroid disease in patients with atrial fibrillation. Heart Vessels. 2024;39(2):185-193. DOI: 10.1007/s00380-023-02341-x
28. Осадчий О.Е. Роль активации симпатической нервной системы в развитии структурно-функциональных изменений миокарда при сердечной недостаточности. Кубанский научный медицинский вестник. 2018;25(1):180-188. DOI: 10.25207/1608-6228-2018-25-1-180-188.
29. Fang SC, Wu YL, Tsai PS. Heart Rate Variability and Risk of All-Cause Death and Cardiovascular Events in Patients With Cardiovascular Disease: A Meta-Analysis of Cohort Studies. Biol Res Nurs. 2020;22(1):45-56. Erratum in: Biol Res Nurs. 2020;22(3):423-425. DOI: 10.1177/1099800419877442
Об авторах
Ю. Ю. ГридневаРоссия
Гриднева Юлия Юрьевна - аспирант кафедры внутренних болезней № 1 ФГБОУ ВО «Ростовский ГМУ» Минздрава России, врач-кардиолог кардиологического отделения №1 ГБУ РО «Ростовская ОКБ».
Ростов-на-Дону
А. И. Чесникова
Россия
Анна Ивановна Чесникова - д. м. н., профессор, заведующая кафедрой внутренних болезней № 1.
Ростов-на-Дону
В. А. Сафроненко
Россия
Виктория Александровна Сафроненко - к. м. н., доцент кафедры внутренних болезней № 1.
Ростов-на-Дону
А. В. Воронова
Россия
Воронова Анна Владимировна - врач ультразвуковой диагностики отделения ультразвуковой диагностики.
Ростов-на-Дону
Дополнительные файлы
Рецензия
Для цитирования:
Гриднева Ю.Ю., Чесникова А.И., Сафроненко В.А., Воронова А.В. Острый инфаркт миокарда у пациентов с сопутствующим гипотиреозом: особенности клиники и вариабельности ритма сердца в период стационарного лечения. Южно-Российский журнал терапевтической практики. 2024;5(2):48-57. https://doi.org/10.21886/2712-8156-2024-5-2-48-57
For citation:
Gridneva Yu.Yu., Chesnikova A.I., Safronenko V.A., Voronova A.V. Acute myocardial infarction in patients with concomitant hypothyroidism: clinical features and heart rate variability during inpatient treatment. South Russian Journal of Therapeutic Practice. 2024;5(2):48-57. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-2-48-57
JATS XML


























