Перейти к:
НАЖБП — предиктор высокого риска развития и ко-фактор прогрессирования сердечно-сосудистых заболеваний
https://doi.org/10.21886/2712-8156-2024-5-2-29-37
Аннотация
На сегодняшний день неалкогольная жировая болезнь печени (НАЖБП) является наиболее распространённой хронической патологией печени и уже на стадии стеатоза обуславливает высокий риск развития сердечно-сосудистых заболеваний (ССЗ). Получены убедительные доказательства, что ССЗ являются наиболее частой причиной смерти у пациентов с НАЖБП. Единые факторы риска (инсулинорезистентность, абдоминальное ожирение, дислипидемия, гиперурикемия, хроническое заболевание почек и сахарный диабет 2 типа) и сходные патофизиологические механизмы (эндотелиальная дисфункция, гиперлипидемия, системное воспаление, образование/нестабильность бляшек, окислительный стресс) НАЖБП и ССЗ позволяют рассматривать НАЖБП не только как ключевой фактор риска развития ССЗ, но и как ко-фактор прогрессирования кардиальной патологии. Прогрессирование самой НАЖБП приводит к более тяжёлому течению ССЗ.
Ключевые слова
Для цитирования:
Шавкута Г.В., Туркина C.В. НАЖБП — предиктор высокого риска развития и ко-фактор прогрессирования сердечно-сосудистых заболеваний. Южно-Российский журнал терапевтической практики. 2024;5(2):29-37. https://doi.org/10.21886/2712-8156-2024-5-2-29-37
For citation:
Shavkuta G.V., Turkina S.V. NAFLD is a predictor of high risk of development and a co-factor in the progression of cardiovascular diseases. South Russian Journal of Therapeutic Practice. 2024;5(2):29-37. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-2-29-37
Введение
Хронические неинфекционные заболевания, несмотря на успехи в профилактических мероприятиях (диспансеризация населения, диспансерное наблюдение, профилактические осмотры) и лечении, являются основной причиной (около 70%) смерти во всём мире прежде всего за счёт сердечно-сосудистых заболеваний (ССЗ) [1]. ССЗ можно рассматривать как фенотип с множественными взаимопересекающимися механизмами, которые включают артериальную гипертензию, ожирение, сахарный диабет, социально-экономические, поведенческие факторы, генетические факторы, а также возраст, пол [2]. В течение последнего десятилетия убедительные доказательства продемонстрировали значимую и многогранную связь между ССЗ и неалкогольной жировой болезнью печени (НАЖБП). НАЖБП представляет собой спектр прогрессирующих фенотипов заболевания печени от стеатоза печени до неалкогольного стеатогепатита (НАСГ), фиброза и цирроза печени. Опубликованные в настоящее время данные показывают, что НАЖБП является преобладающей причиной хронического заболевания печени во многих частях мира, опосредует развитие печёночных осложнений, а также является мультисистемным заболеванием [3–7], которое увеличивает риск ССЗ и смертности от них [8], хронической болезни почек (ХБП) [9], сахарного диабета 2 типа (СД2) [10], внепечёночных форм рака [11][12]. Таким образом, неудивительно, что наличие НАЖБП тесно связано с повышенным риском смертности от всех причин [13][14].
В этом обзоре нам бы хотелось не только обсудить проблему НАЖБП как предиктора формирования ССЗ, но и оценить её вклад в их прогрессирование, а также показать необходимость формирования мультидисциплинарного подхода при диагностике НАЖБП и оценки кардиоваскулярного риска у этой категории пациентов.
Что же известно на сегодняшний момент? Во-первых, достаточное количество исследований продемонстрировало, что НАЖБП является независимым фактором риска сердечно-сосудистых заболеваний [15-18], связана с развитием субклинического атеросклероза [19], исходами субклинических сердечно-сосудистых заболеваний [20], клинически проявляющимся атеросклерозом [21], нестабильными атеросклеротическими бляшками и неблагоприятным исходом [22][23]. В крупномасштабном проспективном когортном исследовании на основе данных UK Biobank (Великобритания), включающем 215245 человек (оценка НАЖБП проводилась с помощью индекса стеатоза печени FLI) осуществлялась оценка таких первичных исходов, как первый случай инфаркта миокарда (ИМ), инсульта или сердечно-сосудистой смерти после поступления. Вторичные исходы были определены как смертность от всех причин, смертность от сердечно-сосудистых заболеваний, смертность от ИМ и инсульта [8]. Среднее время наблюдения составило 11,62 года для смертности от всех причин, 11,61 года — для смертности от ССЗ и 11,59 года — для смертности от ИМ и инсульта. Показано, что НАЖБП была фактором риска смертности от всех причин (ОР 1,14, 95% ДИ 1,08–1,20), смертности от ССЗ (ОР 1,61, 95% ДИ 1,42–1,82) и смертности от ИМ (ОР 1,58, 95% ДИ 1,19–1,82) после поправки на все сопутствующие переменные.
Связь между НАЖБП и риском серьёзных неблагоприятных сердечно-сосудистых событий (МАСЕ) была сильнее среди лиц пожилого возраста (⩾60 лет), не курящих в настоящее время, с индексом массы тела (ИМТ) <25 кг/м² и без артериальной гипертензии (все значения p для взаимодействия <0,01). Аналогичные результаты были получены в отношении смертности от ССЗ. Интересно, что дальнейший анализ взаимосвязи между выраженностью фиброза у этой категории пациентов (использовалась оценка индекса FIB-4) и исходами сердечно-сосудистых заболеваний показал, что риск сердечно-сосудистых заболеваний и смертности от всех причин не был значительно выше в подгруппе с высоким баллом FIB-4. Полученные результаты позволили сделать вывод о том, что выявление НАЖБП уже на стадии стеатоза печени может повысить эффективность прогнозирования риска сердечно-сосудистых заболеваний на основе традиционных факторов риска. Такая необходимость есть и для популяции Российской Федерации: по данным многоцентрового исследования ЭССЭ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации), включающего 5161 респондента с НАЖБП в возрасте 25–64 лет, высокий индекс стеатоза печени FLI≥60 ед., являющийся предиктором стеатоза печен, выявлен у 38,5% мужчин и 26,6% женщин [24].
В настоящее время не вызывает сомнений факт, что НАЖБП не только с ассоциирована с патогенезом кардиоваскулярных заболеваний, но и вносит свой вклад в их развитие.
Возможные патогенетические механизмы, приводящие к формированию кардиоваскулярных осложнений при неалкогольной жировой болезни печени, представлены на рис. 1 [25].
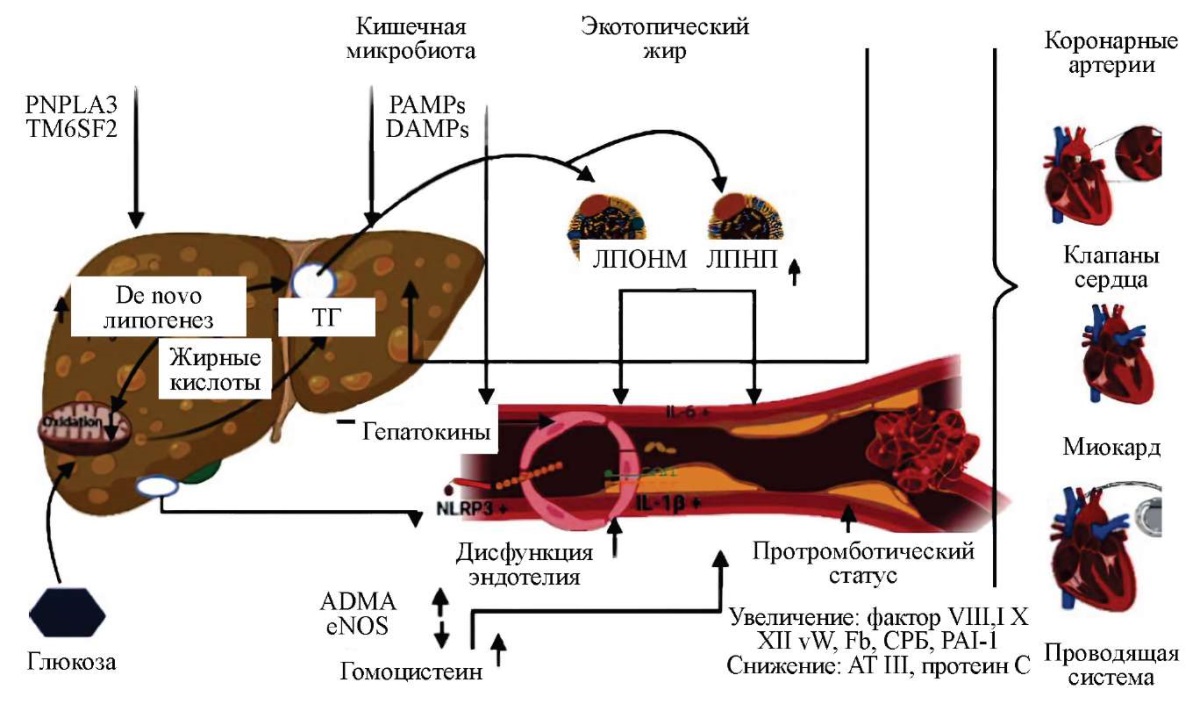
Рисунок 1. Возможные патогенетические механизмы, приводящие к формированию кардиоваскулярных осложнений при неалкогольной жировой болезни печени [25].
Примечание: ADMA — асимметричный диметиларгинин; ATIII — антитромбин III; Fb — фибриноген; IL-6 — интерлейкин 6; IL-1 β — интерлейкин 1 β; ЛПНП — липопротеины низкой плотности; ЛПОНП — липопротеины очень низкой плотности; NLRP3 — белок, содержащий пириновый домен 3; PAI-1 — ингибитор активатора плазминогена-1; PAMPs — патоген-ассоциированные молекулярные паттерны; ген PNPLA3 — белок 3, содержащий пататин-подобный фосфолипазный домен (адипонутрин); ген TM6SF2 — трансмембранный 6 член суперсемейства 2; vW — фактор фон Виллебранда.
Figure 1. Possible pathogenetic mechanisms leading to the formation of cardiovascular complications in non-alcoholic fatty liver disease [25].
Note: ADMA - asymmetric dimethylarginine; ATIII—antithrombin III; Fb - fibrinogen; IL-6 - interleukin 6; IL-1 β - interleukin 1 β; LDL - low density lipoproteins; VLDL - very low density lipoproteins; NLRP3, pyrin domain containing protein 3; PAI-1—plasminogen activator inhibitor-1; PAMPs—pathogen-associated molecular patterns; PNPLA3 gene—protein 3 containing a patatin-like phospholipase domain (adiponutrin); TM6SF2 gene - transmembrane 6 member of superfamily 2; vW - von Willebrand factor.
Сложная физиопатология обоих состояний с общими факторами риска и одновременным вовлечением различных путей затрудняет однозначный вывод о прямой связи между НАЖБП и ССЗ. Однако ясно, что НАЖБ может «запускать» несколько механизмов, что в конечном итоге приводит к развитию сердечно-сосудистых заболеваний. Ось «печень – сердечно-сосудистая система» многогранна, и присутствие НАЖБП опосредует формирование дисфункции жировой ткани и инсулинорезистентность (ИР). Существует очень сложный механизм взаимодействия между кишечником, висцеральной и подкожной жировыми тканями, мышечной тканью, сердечно-сосудистой системой и печенью [26]. Печень, играющая решающую роль в гомеостазе липидов и глюкозы, находится «в эпицентре» кардиометаболических заболеваний. Изменение метаболизма глюкозы и печёночная ИР являются основными признаками НАЖБП и основными элементами патогенеза как НАЖБП, так и ССЗ [27]. Печёночная/периферическая инсулинорезистентность, которая является «визитной карточкой» НАЖБП, влияет на различные процессы, связанные с развитием ССЗ, такие как атерогенез, прогрессирование атеросклеротических поражений и разрыв уязвимых бляшек [25][27][28].
Показано, что важным фактором при этом служит атерогенная дислипидемия, которая выявляется у 20–80% больных с НАЖБП, являясь следствием повышенного de novo липогенеза печени наряду с повышенной скоростью захвата липидов. Причём оба механизма определяют гиперпродукцию и секрецию крупных частиц липопротеинов очень низкой плотности (ЛПОНП), обогащённых триглицеридами, включая аполипопротеин C3 (ApoC3) и аполипопротеин B (ApoB). Атерогенная дислипидемия характеризуется высоким уровнем триглицеридов (ТГ) в сыворотке крови, низким уровнем холестерина липопротеидов высокой плотности (ХС ЛПВП), преобладанием мелких плотных частиц липопротеинов низкой плотности (ХС ЛПНП) и повышенным содержанием липопротеинов средней плотности [29]. Активация толл-подобных рецепторов при проникновении атерогенных липопротеинов через сосудистую стенку с последующей активацией провоспалительного каскада формирования таких цитокинов как IL-1β, IL-6 и C-реактивный белок способствуют воспалительной сосудистой реакции и опосредуют формирование атеросклеротического сердечно-сосудистого заболевания [30]. Окислительный стресс и липопротеин-опосредованное сосудистое воспаление связаны с эндотелиальной дисфункцией, которая характеризуется сниженной биодоступностью оксида азота и является важным патофизиологическим звеном, связывающим НАЖБП и ССЗ [31].
Патофизиология НАЖБП, прежде всего, тесно связана с метаболическим синдромом, кластером факторов риска сердечно-сосудистых заболеваний. Однако пациенты с НАЖБП без избыточного веса/ ожирения (НАЖБП худых [32]) также имеют высокие шансы отклонений в метаболическом профиле с одной стороны, а с другой — высокий риск сердечно-сосудистых заболеваний и неблагоприятного сердечно-сосудистого прогноза по сравнению с пациентами с «метаболически здоровым» фенотипом ожирения [33]. Накопление висцерального жира в печени и миокардиально (внутри и вокруг ткани миокарда) сопровождается формированием системного воспалительного синдрома, высвобождением провоспалительных адипоцитокинов, вызывающих дисфункцию микроциркуляторного русла и фиброз прилегающего миокарда, что также может приводить к развитию фибрилляции предсердий и сердечной недостаточности с сохранённой фракцией выброса, а воспалительные изменения в левом предсердии — к электроанатомическому ремоделированию [34][35].
В недавно опубликованных работах было показано, что гепатокины (белки, которые влияют на метаболический процесс при помощи аутокринного, паракринного и эндокринного сигналинга, секреция которых изменяется в ответ на развитие печёночного стеатоза) являются потенциальными медиаторами кардиометаболического синдрома при НАЖБП [36]. В частности, фетуин А способствует формированию хронического системного воспаления [37], значимо усиливает воспаление печеночной ткани и ИР [38].
Таким образом, НАЖБП находится в эпицентре кардиометаболического континуума (рис. 2) [29].
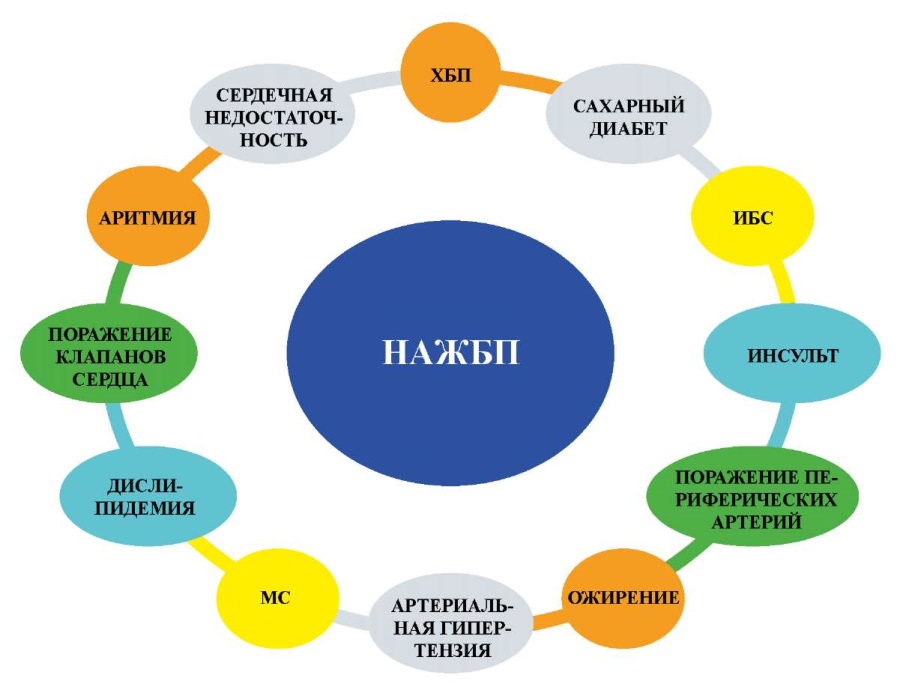
Рисунок 2. Кардиометаболический континуум оси печень – сердце [39].
Figure 2. Cardiometabolic continuum of the liver-heart axis [39].
Хотелось бы отметить, что присутствие и прогрессирование НАЖБП приводит и к более тяжелому течению ССЗ, отягощая сердечно-сосудистый континуум на всех его этапах (рис. 3).
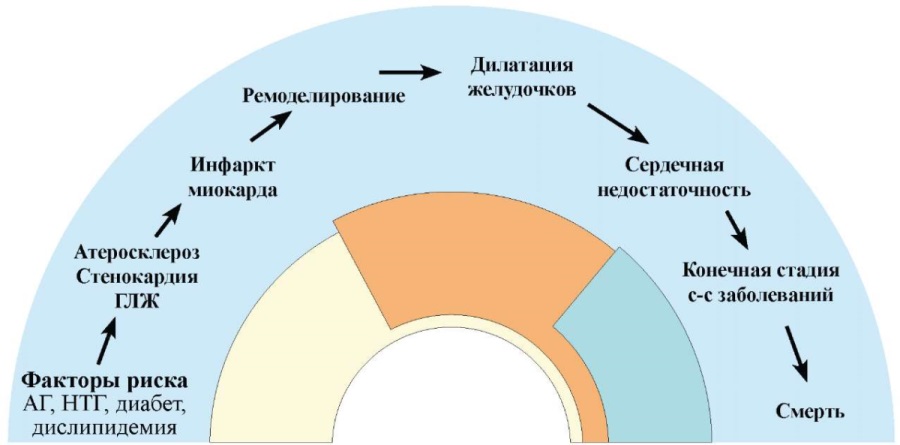
Рисунок 3. НАЖБП и сердечно-сосудистый континуум [40] в модиф. авторов.
Figure 3. NAFLD and cardiovascular continuum [40] modified. authors.
В проспективном исследовании Alper AT, et al [47] было установлено, что НАЖБП является независимым фактором риска, влияющим на тяжесть ишемической болезни сердца (ИБС). Проведённое коронарографическое исследование продемонстрировало значительно более высокие показатели тяжести поражения сосудов (2,5+/-0,9 против 1,0+/-1,0) и тяжести ИБС (90,2+/-40,0 против 36,4+/-28,9) у пациентов с НАЖБП (p <0,001). В многофакторном линейном регрессионном анализе наличие НАЖБП было единственным независимым фактором, влияющим на оценку тяжести ИБС (бета: 1,35, р <0,001). В исследовании, проведённом Boddi М, et al [48], было показано, что по мере увеличения тяжести НАЖБП увеличивались многососудистость атеросклеротического процесса, тяжесть стенозирования коронарных артерий независимо от других факторов риска сердечно-сосудистых заболеваний [49], ухудшались исходы острого инфаркта миокарда как в остром периоде, так и в отдалённой перспективе [23][50-52].
Пациентам с НАЖБП присуще более тяжёлое ремоделирование сердца: по сравнению с пациентами, не страдающими НАЖБП, наблюдалось более высокая частота встречаемости концентрического ремоделирования сердца, увеличение размеров левого предсердия, больший объём левого желудочка (ЛЖ), толщины стенок и индексы массы ЛЖ [53], двукратное увеличение вероятности диастолической сердечной недостаточности среди пациентов с НАЖБП (по сравнению с лицами без НАЖБП) [54]. Наличие НАЖБП не только связано с 1,5-кратным увеличением долгосрочного прогноза риска развития ХСН (объединенный коэффициент риска случайных эффектов 1,50, 95% ДИ от 1,34 до 1,67, p<0,0001; I ² =94,8%); этот риск не зависел от возраста, пола, этнической принадлежности, показателей ожирения, наличия сахарного диабета, артериальной гипертонии и других распространённых сердечно-сосудистых факторов риска [55], но и с тяжестью ХСН и с более высоким риском смертности от всех причин у пациентов, госпитализированных по поводу декомпенсации хронической сердечной недостаточности с сохранённой фракцией выброса [56]. НАЖБП остается независимым фактором, способствующим снижению фракции выброса ЛЖ [57]. Показано, что контингент пациентов с НАЖБП моложе, они имеют более высокий индекс массы тела, большую массу ЛЖ и выраженный фиброз в миокарде ЛЖ [58], что сопровождается более высокими показателями смертности от всех причин в стационаре и после выписки у больных с сердечной недостаточностью с низкой фракцией выброса [59].
НАЖБП и СД 2 типа — два патологических состояния, которые часто сосуществуют и действуют синергически. Показано, что присутствие НАЖБП связано с повышенным риском развития микрососудистых диабетических осложнений, особенно хронической болезни почек, у пациентов с СД не только 2, но и 1 типа [41][42]. По данным когортного исследования Valpolicella Heart Diabetes Study cohort, включающего 2103 пациента с СД 2 типа без предшествующей ХБП, наличие НАЖБП ассоциировалось с почти двукратным увеличение риска (скорректированный HR 1,49, 95% ДИ 1,1–2,2)) развития ХБП независимо от возраста, пола, ИМТ, окружности талии, статуса курения, наличия артериальной гипертензии, длительности СД, уровней HbA1c и липидов, приёма антигипертензивных и гиполипидемических препаратов (средний срок наблюдения за пациентами составил 6,5 гола) [43]. Более того, риск развития ХБП у пациентов с НАЖБП отмечается уже на стадии предиабета [44]. В исследовании Nampoothiri R.V. et al., включавшем пациентов с НАЖБП на стадии стеатоза различной степени тяжести (оценка по данным ультразвукового исследования) и фиброза печени (по данным оценки методом транзиентной эластографии) показано, что наличие сахарного диабета 2 типа, повышенных уровней печёночных трансаминаз и выраженного фиброза можно рассматривать как независимые предикторы нарушения функции почек, при этом повышенные печеночные трансаминазы имеют лучшую чувствительность (89%), а наличие выраженного фиброза — лучшую специфичность (90%). Модель, состоящая из этих трёх параметров, имела хорошую точность (AUROC = 0,763) в прогнозировании нарушения функции почек у пациентов с НАЖБП. Другим прогностическим маркером риска развития ХБП у пациентов с СД 2 типа является изменения индекса FIB-4, показателя неинвазивного фиброза печени [45]. В исследовании Saito H. et al. в ретроспективном когортном анализе у японских пациентов с СД 2 типа (средний период наблюдения составлял 6,0 (3,8–11,0)) лет показано, что риск развития диабетической нефропатии (рСКФ<60 мл/мин./1,73м²) и протеинурии были выше у пациентов с индексом FIB-4 > 1,3, чем у пациентов с FIB4 ≤ 1,3. В регрессионном анализе Кокса индекс FIB-4 > 1,3 был значимым предиктором начала диабетической нефропатии (HR 1,54, 95% CI 1,15–2,08) и протеинурии (HR 1,55, 95% CI 1,08–2,23), но не для рСКФ < 60 мл/мин./1,73м² (ОР 1,14, 95% ДИ 0,79–1,99) [46].
Таким образом, не вызывает сомнений факт необходимости дополнительного скрининга НАЖБП для эффективного прогнозирования неблагоприятных исходов ССЗ. Этот скрининг необходимо проводить даже у пациентов с нормальной массой тела. В ходе выполнения гранта администрации Волгоградской области «Оценка риска сердечно-сосудистых событий у пациентов с неалкогольной жировой болезнью печени с нормальной массой тела в Волгоградской области»1 отмечено, что 12,26% имели нормальную массу тела (ИМТ < 25 кг/м²) (102 пациента в возрасте старше 18 лет, средний возраст — 56,9±9,2 года; в исследование вошло 832 пациента с НАЖБП). Оценка наличия факторов кардиометаболического риска продемонстрировала нарушения углеводного обмена у 50,98% пациентов (из них у 41,17% в рамках сахарного диабета 2 типа), гиперлипидемию — у 55,88%, артериальную гипертензию — у 29,41%. 12,7% пациентов уже имело ИБС, в том числе перенесённый инфаркт миокарда. Оценка риска развития сердечно-сосудистых событий по шкалам SCORE2/SCORE2-OP/SCORE2-Diabetes показала, что только в 2,4% случаев у пациентов с НАЖБП и нормальной массой тела присутствовал низкий риск ССЗ, 43,9% и 53,7% соответствовали среднему и высокому риску ССЗ. В настоящее время в клинических рекомендация по диагностике и лечению неалкогольной жировой болезни печени у взрослых [60] чётко определены этапы необходимого диагностического поиска, а появление медицинских онлайн-калькуляторов значительно повышает скорость и простоту оценки индексов, отражающих выраженность стеатоза, фиброза печени: FLI2, NFS3, FIB-44, а также сердечно-сосудистый риск по шкалам SCORE2/SCORE2-OP/SCORE2-Diabetes5.
Заключение
Поэтому с учётом всех последствий, которые связаны с НАЖБП, крайне важно, чтобы терапевты, врачи общей практики и гепатологи работали совместно с кардиологами, эндокринологами и другими специалистами для разработки стратегий ведения этой категории пациентов, применяя мультидисциплинарный подход не только в лечении пациента с НАЖБП, но и осуществлении раннего скрининга этого заболевания.
1. Туркина С.В., Тыщенко И.А., Косивцова М.А., Тумаренко А.В., Родионова И.В., Устинова М.В. и др. Свидетельство о государственной регистрации базы данных «Оценка риска сердечно-сосудистых осложнений у лиц с неалкогольной жировой болезнью печени с нормальной массой тела» № 2023621531, 17 мая 2023 г.
2. https://www.mdcalc.com/fatty-liver-index
3. https://nafldscore.com/
4. https://www.hepatitisc.uw.edu/page/clinical-calculators/fib-4
5. https://medsoftpro.ru/kalkulyatory/score2-scale.html
Список литературы
1. World Health Organization. Global Health Estimates 2019: Disease Burden by Cause, Age, Sex, by Country and by Region, 2000–2019. WHO; Geneva, Switzerland: 2021.
2. Arnett D.K., Blumenthal R.S., Albert M.A., Buroker A.B., Goldberger Z.D., Hahn E.J. et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease. Circulation. 2019;74:1376–1414. DOI: 10.1016/j.jacc.2019.03.010
3. Лазебник Л. Б., Туркина С. В. НАЖБП-ассоциированная коморбидность. Экспериментальная и клиническая гастроэнтерология. 2021;194(10):5–13. DOI: 10.31146/1682-8658-ecg-194-10-5-13
4. Ивашкин В.Т., Маевская М.В., Жаркова М.С., Котовская Ю.В., Ткачева О.Н., Трошина Е.А. и др. Клинические рекомендации Российского общества по изучению печени, Российской гастроэнтерологической ассоциации, Российской ассоциации эндокринологов, Российской ассоциации геронтологов и гериатров и Национального общества профилактической кардиологии по диагностике и лечению неалкогольной жировой болезни печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2022;32(4):104-140. DOI: 10.22416/1382-4376-2022-32-4-104-140
5. Маевская М.В., Котовская Ю.В., Ивашкин В.Т., Ткачева О.Н., Трошина Е.А., Шестакова М.В. и др. Национальный Консенсус для врачей по ведению взрослых пациентов с неалкогольной жировой болезнью печени и ее основными коморбидными состояниями. Терапевтический архив. 2022;94(2):216–253. DOI: 10.26442/00403660.2022.02.201363
6. Moolla A, Motohashi K, Marjot T, Shard A, Ainsworth M, Gray A. et al. A multidisciplinary approach to the management of NAFLD is associated with improvement in markers of liver and cardio-metabolic health. Frontline Gastroenterol. 2019;10(4):337-346. DOI: 10.1136/flgastro-2018-101155
7. Targher G., Tilg H., Byrne C.D. Non-alcoholic fatty liver disease: a multisystem disease requiring a multidisciplinary and holistic approach. Lancet Gastroenterol Hepatol. 2021;6(7):578-588. DOI: 10.1016/S2468-1253(21)00020-0
8. Ma W., Wu W., Wen W., Xu F., Han D., Lyu J. et al. Association of NAFLD with cardiovascular disease and all-cause mortality: a large-scale prospective cohort study based on UK Biobank. Ther Adv Chronic Dis. 2022;13:20406223221122478. DOI: 10.1177/20406223221122478
9. Lonardo A., Mantovani A., Targher G., Baffy G. Nonalcoholic Fatty Liver Disease and Chronic Kidney Disease: Epidemiology, Pathogenesis, and Clinical and Research Implications. Int. J. Mol. 2022;23(21):13320. DOI: 10.3390/ijms232113320
10. Kosmalski M., Śliwińska A., Drzewoski J. Non-Alcoholic Fatty Liver Disease or Type 2 Diabetes Mellitus—The Chicken or the Egg Dilemma. Biomedicines. 2023;11(4):1097. DOI: 10.3390/biomedicines11041097
11. Mantovani A., Petracca G., Beatrice G., Csermely A., Tilg H., Byrne C.D. et al. Non-alcoholic fatty liver disease and increased risk of incident extrahepatic cancers: a meta-analysis of observational cohort studies. Gut. 2022;71(4):778-788. DOI: 10.1136/gutjnl-2021-324191
12. McHenry S., Zong X., Shi M., Fritz C.D.L., Pedersen K.S., Peterson L.R. et al. Risk of nonalcoholic fatty liver disease and associations with gastrointestinal cancers. Hepatol Commun. 2022;6(12):3299-3310. DOI: 10.1002/hep4.2073
13. Taylor R.S., Taylor R.J., Bayliss S., Hagström H., Nasr P., Schattenberg J.M. et al. Association Between Fibrosis Stage and Outcomes of Patients With Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-Analysis. Gastroenterology. 2020;158(6):1611-1625.e12. DOI: 10.1053/j.gastro.2020.01.043
14. Simon T.G., Roelstraete B., Khalili H., Hagström H., Ludvigsson J.F. Mortality in biopsy-confirmed nonalcoholic fatty liver disease: results from a nationwide cohort. Gut. 2021;70(7):1375–1382. DOI: 10.1136/gutjnl-2020–322786.
15. Oni E.T., Agatston A.S., Blaha M.J., Fialkow J., Cury R., Sposito A. et al. A systematic review: burden and severity of subclinical cardiovascular disease among those with nonalcoholic fatty liver; should we care? Atherosclerosis. 2013;230(2):258-267. DOI: 10.1016/j.atherosclerosis.2013.07.052
16. Zeb I., Li D., Budoff M.J., Katz R., Lloyd-Jones D., Agatston A. Nonalcoholic Fatty Liver Disease and Incident Cardiac Events: The Multi-Ethnic Study of Atherosclerosis. J Am Coll Cardiol. 2016;67(16):1965-1966. DOI: 10.1016/j.jacc.2016.01.070
17. Mantovani A., Mingolla L., Rigolon R., Pichiri I., Cavalieri V., Zoppini G. et al. Nonalcoholic fatty liver disease is independently associated with an increased incidence of cardiovascular disease in adult patients with type 1 diabetes. Int J Cardiol. 2016;225:387-391. DOI: 10.1016/j.ijcard.2016.10.040
18. Targher G., Byrne C.D., Lonardo A., Zoppini G., Barbui C. Non-alcoholic fatty liver disease and risk of incident cardiovascular disease: A meta-analysis. J Hepatol. 2016;65(3):589-600. DOI: 10.1016/j.jhep.2016.05.013
19. Adams L.A., Anstee Q.M., Tilg H., Targher G. Non-alcoholic fatty liver disease and its relationship with cardiovascular disease and other extrahepatic diseases. Gut. 2017;66(6):1138-1153. DOI: 10.1136/gutjnl-2017-313884
20. Mellinger J.L., Pencina K.M., Massaro J.M., Hoffmann U., Seshadri S., Fox C.S. et al. Hepatic steatosis and cardiovascular disease outcomes: An analysis of the Framingham Heart Study. J Hepatol. 2015;63(2):470-476. DOI: 10.1016/j.jhep.2015.02.045
21. Haddad T.M., Hamdeh S., Kanmanthareddy A., Alla V.M. Nonalcoholic fatty liver disease and the risk of clinical cardiovascular events: A systematic review and meta-analysis. Diabetes Metab Syndr. 2017;11 Suppl 1:S209-S216. DOI: 10.1016/j.dsx.2016.12.033
22. Osawa K., Miyoshi T., Yamauchi K., Koyama Y., Nakamura K., Sato S. et al. Nonalcoholic Hepatic Steatosis Is a Strong Predictor of High-Risk Coronary-Artery Plaques as Determined by Multidetector CT. PLoS One. 2015;10(6):e0131138. DOI: 10.1371/journal.pone.0131138
23. Keskin M., Hayıroğlu M.İ., Uzun A.O., Güvenç T.S., Şahin S., Kozan Ö. Effect of Nonalcoholic Fatty Liver Disease on In-Hospital and Long-Term Outcomes in Patients With ST-Segment Elevation Myocardial Infarction. Am J Cardiol. 2017;120(10):1720-1726. DOI: 10.1016/j.amjcard.2017.07.107
24. Евстифеева С.Е., Шальнова С.А., Куценко В.А., Яровая Е.Б., Баланова Ю.А., Имаева А.Э. и др. Распространенность неалкогольной жировой болезни печени среди населения трудоспособного возраста: ассоциации с социально-демографическими показателями и поведенческими факторами риска (данные ЭССЕ-РФ-2). Кардиоваскулярная терапия и профилактика. 2022;21(9):3356. DOI: 10.15829/1728-8800-2022-3356
25. Chiriac S., Stanciu C., Girleanu I., Cojocariu C., Sfarti C., Singeap A-M. et al. Nonalcoholic Fatty Liver Disease and Cardiovascular Diseases: The Heart of the Matter. Can J Gastroenterol Hepatol. 2021;2021:6696857. DOI: 10.1155/2021/6696857
26. Francque S. The Liver and the Cardiovascular System: Two of a Kind? J Am Heart Assoc. 2021;10(8):e020286. DOI: 10.1161/JAHA.121.020286
27. Stahl E.P., Dhindsa D.S., Lee S.K., Sandesara P.B., Chalasani N.P., Sperling L.S. Nonalcoholic fatty liver disease and the heart: JACC state-of-the-art review. J Am Coll Cardiol. 2019;73(8):948-963. DOI: 10.1016/j.jacc.2018.11.050
28. Kasper P., Martin A., Lang S., Kütting F., Goeser T., Demir M. et al. NAFLD and cardiovascular diseases: a clinical review. Clin Res Cardiol. 2021;110(7):921-937. DOI: 10.1007/s00392-020-01709-7
29. Lechner K., McKenzie A.L., Kränkel N., Von Schacky C., Worm N., Nixdorff U. et al. High-Risk Atherosclerosis and Metabolic Phenotype: The Roles of Ectopic Adiposity, Atherogenic Dyslipidemia, and Inflammation. Metab Syndr Relat Disord. 2020;18(4):176-185. DOI: 10.1089/met.2019.0115
30. Libby P., Everett B.M. Novel Antiatherosclerotic Therapies. Arterioscler Thromb Vasc Biol. 2019;39(4):538-545. DOI: 10.1161/ATVBAHA.118.310958
31. Francque S.M., van der Graaff D., Kwanten W.J. Non-alcoholic fatty liver disease and cardiovascular risk: Pathophysiological mechanisms and implications. J Hepatol. 2016;65(2):425-43. DOI: 10.1016/j.jhep.2016.04.005
32. Young S., Tariq R., Provenza J., Satapathy S.K., Faisal K., Choudhry A., et al. Prevalence and Profile of Nonalcoholic Fatty Liver Disease in Lean Adults: Systematic Review and Meta-Analysis. Hepatol Commun. 2020;4(7):953-972. DOI: 10.1002/hep4.1519
33. Zakerkish M, Hoseinian A, Alipour M, Payami SP. The Association between Cardio-metabolic and hepatic indices and anthropometric measures with metabolically obesity phenotypes: a cross-sectional study from the Hoveyzeh Cohort Study. BMC Endocr Disord. 2023;23(1):122. DOI: 10.1186/s12902-023-01372-9
34. Packer M. Epicardial Adipose Tissue May Mediate Deleterious Effects of Obesity and Inflammation on the Myocardium. J Am Coll Cardiol. 2018;71(20):2360-2372. DOI: 10.1016/j.jacc.2018.03.509
35. Gruzdeva O., Uchasova E., Dyleva Y., Borodkina D., Akbasheva O., Antonova L. et al. Adipocytes Directly Affect Coronary Artery Disease Pathogenesis via Induction of Adipokine and Cytokine Imbalances. Front Immunol. 2019;10:2163. DOI: 10.3389/fimmu.2019.02163
36. Meex R.C.R., Watt M.J. Hepatokines: linking nonalcoholic fatty liver disease and insulin resistance. Nat Rev Endocrinol. 2017;13(9):509–520. DOI: 10.1038/nrendo.2017.56
37. Jensen-Cody S.O., Potthoff M.J. Hepatokines and metabolism: Deciphering communication from the liver. Mol Metab. 2021;44:101138. DOI: 10.1016/j.molmet.2020.101138
38. Lee S., Norheim F., Gulseth H.L. Langleite T.M., Kolnes K.J., Tangen D.S. et al. Interaction between plasma fetuin‐A and free fatty acids predicts changes in insulin sensitivity in response to long‐term exercise. Physiol Rep. 2017;5(5):e13183. DOI: 10.14814/phy2.13183
39. Niederseer D., Wernly B., Aigner E., Stickel F., Datz C. NAFLD and Cardiovascular Diseases: Epidemiological, Mechanistic and Therapeutic Considerations. J Clin Med. 2021;10(3):467. DOI: 10.3390/jcm10030467
40. Dzau V., Braunwald E. Resolved and unresolved issues in the prevention and treatment of coronary artery disease: a workshop consensus statement. Am Heart J. 1991;121(4 Pt 1):1244-1263. DOI: 10.1016/0002-8703(91)90694-d
41. Targher G., Lonardo A., Byrne C.D. Nonalcoholic fatty liver disease and chronic vascular complications of diabetes mellitus. Nat Rev Endocrinol. 2018;14(2):99-114. DOI: 10.1038/nrendo.2017.173
42. Targher G., Mantovani A., Pichiri I., Mingolla L., Cavalieri V., Mantovani W. et al. Nonalcoholic fatty liver disease is independently associated with an increased incidence of chronic kidney disease in patients with type 1 diabetes. Diabetes Care. 2014;37(6):1729-36. DOI: 10.2337/dc13-2704
43. Targher G., Bertolini L., Rodella S., Zoppini G., Lippi G., Day C. et al. Non-alcoholic fatty liver disease is independently associated with an increased prevalence of chronic kidney disease and proliferative/laser-treated retinopathy in type 2 diabetic patients. Diabetologia. 2008;51(3):444-50. DOI: 10.1007/s00125-007-0897-4
44. Li Y., Zhu S., Li B., Shao X., Liu X., Liu A. et al. Association between non-alcoholic fatty liver disease and chronic kidney disease in population with prediabetes or diabetes. Int Urol Nephrol. 2014;46(9):1785-1791. DOI: 10.1007/s11255-014-0796-9
45. Nampoothiri R.V., Duseja A., Rathi M., Agrawal S., Sachdeva N., Mehta M. et al. Renal Dysfunction in Patients With Nonalcoholic Fatty Liver Disease is Related to the Presence of Diabetes Mellitus and Severity of Liver Disease. J Clin Exp Hepatol. 2019;9(1):22-28. DOI: 10.1016/j.jceh.2017.12.005.
46. Saito H., Tanabe H., Kudo A. Machii N., Higa M., Yamaguchi S. et al. High FIB4 index is an independent risk factor of diabetic kidney disease in type 2 diabetes. Sci Rep. 2021;11(1):11753. DOI: 10.1038/s41598-021-88285-6.
47. Alper A.T., Hasdemir H., Sahin S., Ontürk E., Akyol A., Nurkalem Z. et al. The relationship between nonalcoholic fatty liver disease and the severity of coronary artery disease in patients with metabolic syndrome. Turk Kardiyol Dern Ars. 2008;36(6):376-381. PMID: 19155640
48. Boddi M., Tarquini R., Chiostri M., Marra F., Valente S., Giglioli C. et al. Nonalcoholic fatty liver in nondiabetic patients with acute coronary syndromes. Eur J Clin Invest. 2013;43(5):429-438. DOI: 10.1111/eci.12065
49. Wang X., Shen L., Shen Y., Han .F, Ji Z. Association between Non-alcoholic Fatty Liver Disease and the Severity of Coronary Artery Stenosis in Eastern Chinese Population. Hepat Mon. 2021;21(11):e122772. DOI: 10.5812/hepatmon.122772
50. Perera N., Indrakumar J., Abeysinghe W.V., Fernando V., Samaraweera W.M., Lawrence J.S.. Non alcoholic fatty liver disease increases the mortality from acute coronary syndrome: an observational study from Sri Lanka. BMC Cardiovasc Disord. 2016;16:37. DOI: 10.1186/s12872-016-0212-8
51. Emre A., Terzi S., Celiker E., Sahin S., Yazıcı S., Erdem A. Impact of Nonalcoholic Fatty Liver Disease on Myocardial Perfusion in Nondiabetic Patients Undergoing Primary Percutaneous Coronary Intervention for ST-Segment Elevation Myocardial Infarction. Am J Cardiol. 2015;116(12):1810-1814. DOI: 10.1016/j.amjcard.2015.09.021
52. Wong V.W., Wong G.L., Yeung J.C., Fung C.Y., Chan J.K., Chang Z.H. et al. Long-term clinical outcomes after fatty liver screening in patients undergoing coronary angiogram: A prospective cohort study. Hepatology. 2016;63(3):754-763. DOI: 10.1002/hep.28253
53. Borges-Canha M., Neves J.S., Libânio D., Von-Hafe M., Vale C., Araújo-Martins M. et al. Association between nonalcoholic fatty liver disease and cardiac function and structure-a meta-analysis. Endocrine. 2019;66(3):467-476. DOI: 10.1007/s12020-019-02070-0
54. Wijarnpreecha K., Lou S., Panjawatanan P., Cheungpasitporn W., Pungpapong S., Lukens F.J. et al. Association between diastolic cardiac dysfunction and nonalcoholic fatty liver disease: a systematic review and meta-analysis. Dig Liver Dis. 2018;50(11):1166-1175. DOI: 10.1016/j.dld.2018.09.004
55. Мantovani A., Petracca G., Csermely A., Beatrice G., Bonapace S., Rossi A. et al. Non-alcoholic fatty liver disease and risk of new-onset heart failure: an updated meta-analysis of about 11 million individuals. Gut. 2022:gutjnl-2022-327672. DOI: 10.1136/gutjnl-2022-327672
56. Yoshihisa A., Sato Y., Yokokawa T., Sato T., Suzuki S., Oikawa M., et al. Liver fibrosis score predicts mortality in heart failure patients with preserved ejection fraction. ESC Heart Fail. 2018;5(2):262-270. DOI: 10.1002/ehf2.12222
57. Trovato F.M., Martines G.F., Catalano D., Musumeci G., Pirri C., Trovato G.M. Echocardiography and NAFLD (non-alcoholic fatty liver disease). Int J Cardiol. 2016;221:275-279. DOI: 10.1016/j.ijcard.2016.06.180
58. Zhang Z., Wang P., Guo F., Liu X., Luo T., Guan Y., et al. Chronic heart failure in patients with nonalcoholic fatty liver disease: prevalence, clinical features, and relevance. J Int Med Res. 2018;46(9):3959-3969. DOI: 10.1177/0300060518782780
59. Valbusa F., Agnoletti D., Scala L., Grillo C., Arduini P., Bonapace S. et al. Non-alcoholic fatty liver disease and increased risk of all-cause mortality in elderly patients admitted for acute heart failure. Int J Cardiol. 2018;265:162-168. DOI: 10.1016/j.ijcard.2018.04.129
60. Лазебник Л.Б., Голованова Е.В., Туркина С.В., Райхельсон К.Л., Оковитый С.В., Драпкина О.М. и др. Неалкогольная жировая болезнь печени у взрослых: клиника, диагностика, лечение. Рекомендации для терапевтов, третья версия. Экспериментальная и клиническая гастроэнтерология. 2021;185(1):4-52. DOI: 10.31146/1682-8658-ecg-185-1-4-52
Об авторах
Г. В. ШавкутаРоссия
Шавкута Галина Владимировна - д.м.н., профессор, заведующая кафедрой общей врачебной практики (семейной медицины) (с курсам гериатрии и физиотерапии).
Ростов-на-Дону
C. В. Туркина
Россия
Туркина Светлана Владимировна - д.м.н., профессор кафедры внутренних болезней.
Волгоград
Рецензия
Для цитирования:
Шавкута Г.В., Туркина C.В. НАЖБП — предиктор высокого риска развития и ко-фактор прогрессирования сердечно-сосудистых заболеваний. Южно-Российский журнал терапевтической практики. 2024;5(2):29-37. https://doi.org/10.21886/2712-8156-2024-5-2-29-37
For citation:
Shavkuta G.V., Turkina S.V. NAFLD is a predictor of high risk of development and a co-factor in the progression of cardiovascular diseases. South Russian Journal of Therapeutic Practice. 2024;5(2):29-37. (In Russ.) https://doi.org/10.21886/2712-8156-2024-5-2-29-37
JATS XML


























